Après avoir parcouru le 19ème siècle avec Dmitri Mendeleïev, entrons dans le 20ème (lui le quittera rapidement, en 1907, à une semaine de son 74ème anniversaire). Dans la première partie de ce nouveau siècle, la connaissance intime de la matière connut des progrès considérables avec la preuve de l’existence des atomes et de leurs constituants : l’électron, le proton puis le neutron. Constituants ? Eh oui, on a été un peu vite en besogne en qualifiant cela d’atome (du grec « insécable »). Et ces atomes ont bien sûr tout à voir avec notre tableau…
Derrière le tableau
L’image que nous pouvons nous faire de l’atome (qui est aussi utile que fausse… mais nous y reviendrons) est la suivante : des protons (possédant une charge électrique positive) et des neutrons (électriquement neutres) agglutinés pour former un noyau autour duquel tournent de « petits » électrons (possédant une charge électrique négative).
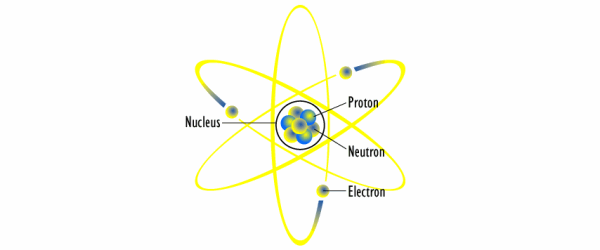
Je dis « petits », je devrais dire « légers » car la masse du noyau concentre à lui seul 99,9% de la masse de l’atome ! Le proton est 1 835 fois plus lourd que l’électron. Idem pour le neutron (qui possède une masse un tout petit peu plus grande que le proton).
Si vous deviez vous représenter un atome à notre échelle, imaginez que son noyau soit de la taille d’un ballon de Football. Les électrons lui tournant autour seraient des petits pois situés… à plus de dix kilomètres de là ! Un atome… c’est avant tout du vide.
Ce qui signifie donc que vous-même, cher lecteur, êtes avant tout du vide.
Mais laissons-là la vacuité de nos existences, et revenons à nos éléments chimiques. Ce qui caractérise principalement un atome, c’est tout simplement son nombre de protons (appelé aussi « numéro atomique »). Et c’est ici que nous retrouvons nos 94 éléments. Le plus léger de ces éléments, l’hydrogène, correspond en fait à un atome possédant un proton. Le suivant, l’hélium, possède deux protons. Le suivant, le lithium, possède trois protons. Et ainsi de suite jusqu’au 94 protons du plutonium. Cela explique aussi pourquoi il n’y a pas d’élément chimique inconnu qui se serait dissimulé au milieu de nos 94 éléments : l’azote a sept protons, l’oxygène huit protons, et il ne peut y avoir, entre les deux, un élément caché qui posséderait 7 protons et demi. Les « demi-protons », ça n’existe pas.
Et l’électron dans tout ça ?
Un atome est électriquement neutre. Cela signifie qu’il possède autant d’électrons (charges « – ») que de protons (charges « + »).
Cependant, contrairement aux protons, confortablement nichés dans leur noyau, les électrons se « promènent », eux, à la périphérie de l’atome. Et il arrive que certains aillent voir ailleurs si la vie est plus belle ou, inversement, s’invitent autour de notre atome parce que la vie semble y être plus belle (on verra dans la prochaine partie, ce que cette notion de « plus belle la vie » signifie).
Si un atome perd ou gagne un ou plusieurs électrons, il perd sa neutralité électrique et devient un « ion » (oui, je sais, c’est ridicule comme mot).
S’il en perd, il devient un ion positif, ou cation (puisque les protons deviennent majoritaires).
S’il en gagne, il devient un ion négatif, ou anion (puisque les électrons deviennent majoritaires).
Et le neutron dans tout ça ?
Dès qu’un noyau d’atome possède plusieurs protons, ceux-ci ont tendance à ne pas très bien s’entendre entre eux. Heureusement, notre ami neutron, fort semblable au proton mais d’une neutralité absolue (électriquement j’entends), vient se glisser entre eux, et calmer les choses. Pour qu’un noyau soit stable, il faut donc, en fonction du nombre de protons, qu’il possède de nombreux neutrons. Mais il arrive que ce nombre de neutrons varie pour un même type d’atome.
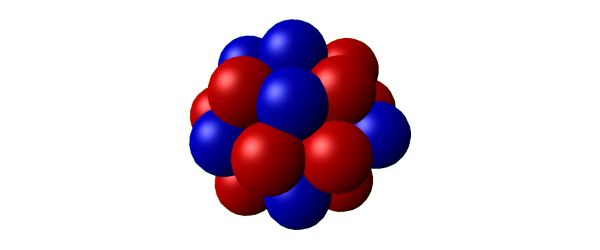
Prenons l’exemple de l’atome de carbone. Celui-ci possède 6 protons (sinon, ce ne serait pas du carbone). La plupart des atomes de carbone possèdent également 6 neutrons. On appelle donc cela du « carbone 12 » (12C) car ces atomes possèdent dans leur noyau 12 nucléons (protons+neutrons).
Il existe aussi, en moins grand nombre, des atomes de « carbone 13 », avec donc 7 neutrons dans leur noyau.
Mais il arrive aussi qu’un atome d’azote (7 protons + 7 neutrons), se baladant pépère dans l’atmosphère, se prenne sur la tronche un neutron venu de l’espace (ce n’est pas qu’une image). Le choc lui fait éjecter un proton mais lui fait gagner ce neutron. Et il devient le fameux « carbone 14 » (6 protons + 8 neutrons). C’est un petit peu déséquilibré pour son noyau, et cela lui donne la nausée. Une nausée qui peut durer très longtemps. Au bout de 5730 années, un atome de « carbone 14 » sur deux aura réglé le problème en transformant l’un de ses neutrons en proton (non sans vomir un électron issu de cette transformation… ainsi qu’un anti-neutrino… oubliez). En faisant cela, il redevient de « l’azote 14 » (7 protons + 7 neutrons). Et là, plus de gargouillis, le noyau est stable.
Un tel comportement s’appelle… la radio-activité (plus précisément la radio-activité bêta, on en parle dans la dernière partie). C’est utile pour dater des tas de trucs (et ça on n’en parlera pas non plus maintenant). On dit donc que le carbone 14 est radio-actif avec une demi-vie de 5730 ans : la moitié d’un gros paquet de 14C se transforme (en azote, 14N) en 5730 ans, puis la moitié de la moitié restante en 5730 ans supplémentaires, puis la moitié de la moité restante en… etc.
Tant qu’on y est, côté définitions, ces différentes formes d’un même atome, s’appellent des « isotopes ». Ainsi, le carbone possède deux isotopes stables (12C et 13C) et plein d’isotopes radio-actifs dont le 14C (la plupart des autres ayant une demi-vie inférieure à 200 millisecondes).
Vous pouvez voir ci-dessous trois isotopes de l’hydrogène : un proton sans neutron (1H, le plus courant, 99,98% de l’hydrogène), avec un neutron (2H, nommé « deutérium »), et avec deux neutrons (3H, nommé « tritium »).
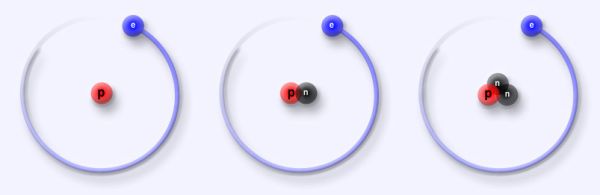
Hormis cette éventuelle instabilité concernant leur noyau, et une exception concernant l’hydrogène (le neutron étant lourd au regard de son modeste noyau), tous les isotopes d’un même élément conservent des propriétés chimiques identiques. Le carbone reste le carbone que ce soit du 12C, du 13C ou du 14C. Et il y a une bonne raison à cela : les propriétés chimiques d’un atome ne sont pas déterminées par son noyau mais par ce qui se passe autour de lui, du côté des électrons. Et il s’en passe des choses…
Le joli tableau de Mendeleïev
- Partie 1 : Esquisse et présentation du tableau
- Partie 2 : Derrière le tableau
- Partie 3 : La chimie dans le tableau
- Partie 4 : Le nucléaire dans le tableau




