Après avoir présenté le tableau de Mendeleïev et évoqué les atomes qui le constituent, nous nous sommes intéressés aux relations que pouvaient entretenir ces atomes, ce que l’on appelle la chimie. Il nous reste à évoquer le vieux rêve des alchimistes : changer le plomb en or. Pour notre tableau, cela revient à faire passer un élément d’une case à l’autre. Mais contrairement à ce qu’avaient espéré des générations d’alchimistes, ici, il ne s’agit plus de chimie. Cela concerne le noyau des atomes, autrement dit la physique nucléaire…
Le nucléaire dans le tableau
Comme je l’ai indiqué, ce qui caractérise un atome (sa place dans le tableau), c’est le nombre de protons que possède son noyau. Pour qu’il puisse changer de case dans le tableau, il faut donc qu’il puisse modifier le nombre de protons présents dans son noyau. Il peut y parvenir seul mais on peut aussi l’aider…
Radioactivité
Nous l’avons vu dans la deuxième partie consacrée aux atomes : certains isotopes d’un atome possèdent des noyaux instables. Leur noyau possède trop ou pas assez de neutrons pour que l’édifice puisse tenir.
Mieux, il existe des atomes qui ne possèdent aucun isotope stable. Les atomes plus lourds que nos 94 du début, sont tous instables (ils ont tellement de protons que, peu importe le nombre de neutrons, cela ne tient pas). Mais ils ne sont pas les seuls : certains de ces 94 premiers éléments, parmi les plus lourds, ne possèdent eux aussi aucun état stable. C’est, par exemple, le cas de l’uranium, du plutonium, du radium ou du radon.
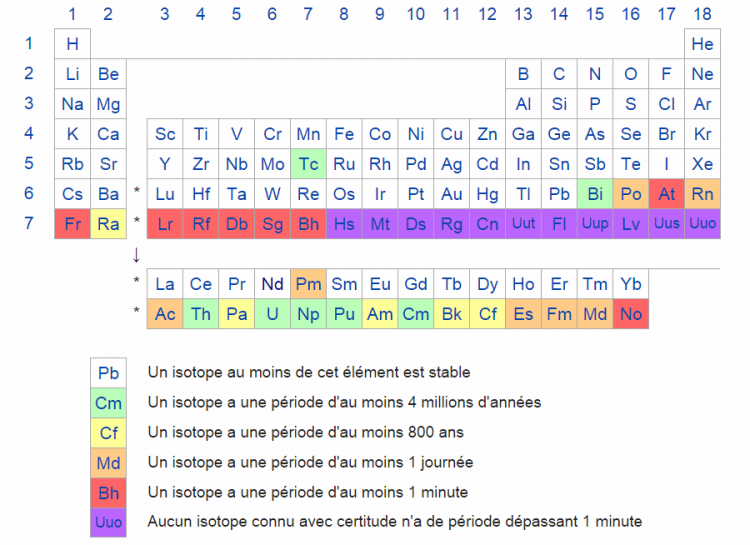
A ce sujet, revoici notre tableau mais cette fois-ci, il met en évidence les éléments stables et instables…
S’ils sont instables, ces noyaux vont finir, au bout d’un temps très court pour certains, ou très long pour d’autres, par régler le problème. Le règlement de ce problème, cela s’appelle… brrr… la radioactivité. Et cela peut se produire de différentes façons, selon la nature du problème à régler. Je sais que cela vous fait peur mais nous allons revêtir notre combinaison de protection et analyser tout ça.
Excès de neutrons
Comme nous l’avions vu dans l’exemple du « carbone 14 », l’atome résout son problème en transformant l’un de ses neutrons en proton. Il saute ainsi à la case de droite dans le tableau (le « carbone 14 » devient de « l’azote 14 » qui, lui, est stable). Cette opération dégage beaucoup d’énergie sous la forme de l’émission d’un anti-neutrino (une particule fantomatique qui ne vous fera pas peur) mais aussi d’un électron créé à cette occasion (c’est ce que l’on nomme « radioactivité bêta–»). Cet électron, vu sa grande vitesse, peut faire des dégâts (notamment en tapant les grosses et longues molécules complexes qui nous constituent). Et ce n’est pas fini : du fait de cette transmutation, l’atome se trouve tout excité, et pour se calmer, il va alors émettre un rayonnement gamma (« radioactivité gamma »). Là, c’est comme des rayons X mais en encore plus costauds. Cela peut donc aussi faire du dégât. Bien moins que l’électron ultra-rapide mais, si ce dernier peut être stoppé par une simple feuille d’aluminium, le rayon gamma, lui, peut encore trouver le moyen de passer à travers plusieurs mètres de béton. Pour finir de vous rassurer, sachez tout de même que vous en recevez régulièrement de ces petites choses-là, du fait de la radioactivité naturelle. Mais c’est comme tout, faut juste éviter les excès.
Excès de protons
En parlant d’excès, le noyau qui a trop de protons (ou pas assez de neutrons si vous préférez) va, lui, utiliser la méthode inverse : transformer un de ses protons en neutron. Il saute ainsi à la case de gauche dans le tableau. La différence avec le cas précédent, c’est que ce n’est pas un anti-neutrino et un électron qui sont éjectés mais un neutrino et un positon (un électron possédant une charge électrique positive). C’est ce que l’on nomme « radioactivité bêta+ ». Mais là, notre positon va aussitôt s’accoquiner avec l’un des électrons de l’atome. Et ce flirt va immédiatement se conclure par l’annihilation des deux amants, dans un feu d’artifice de rayons gamma… A éviter aussi.
Excès de tout (protons + neutrons)
Quand vraiment trop, c’est trop… L’atome va alors carrément se délester d’un bloc de deux protons et deux neutrons (ce qui correspond à un noyau d’hélium). L’expulsion de ce noyau d’hélium correspond à la « radioactivité alpha » (cette fois, il n’y a généralement pas de rayonnement gamma qui l’accompagne). En perdant deux protons, l’atome saute donc de deux cases vers la gauche. Ce noyau d’hélium éjecté – des milliers de fois plus lourd qu’un électron – peut faire de très gros dégâts. Heureusement, une simple feuille de papier le stoppe. Il faut juste que cela ne se passe pas à l’intérieur de votre corps après avoir ingéré ou inhalé ces atomes radioactifs.
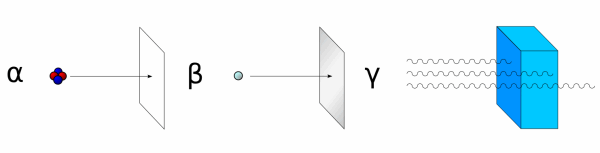
Voici, ici représentée, la capacité à traverser la matière des trois rayonnements ionisants dont nous venons de parler (alpha, bêta et gamma) avec une feuille de papier, une feuille d’aluminium et trois mètres de béton…
Très gros excès de tout
Dans des cas rares, concernant des atomes très lourds, l’énorme noyau va utiliser une solution radicale : se scinder en plusieurs fragments (généralement deux), non sans éjecter un ou plusieurs neutrons au passage, et libérer une énorme énergie. On se retrouve donc avec des atomes plus légers… mais ceux-ci sont encore instables, et vont finir par utiliser les méthodes précédentes pour enfin trouver de la stabilité, si besoin en plusieurs étapes (on appelle cela une chaîne de désintégration). Ces fragments radio-actifs, issus de la fission de plus gros atomes, sont d’ailleurs parfois les seuls exemplaires existants dans la nature de certains de nos 94 atomes.
Cette fission nucléaire qui est ici spontanée, peut également être induite. Voyons cela de plus près (c’est une expression, on ne s’approche pas trop)…
Fission nucléaire
La fission dont nous venons de parler est dite « spontanée » car rien n’est venu de l’extérieur pour obliger l’atome à se scinder en plusieurs morceaux. Les atomes capables d’adopter ce comportement sont rares, mais il en existe d’autres qui sont dits « fissiles ». Fissiles, car ils ont juste besoin d’un coup de pouce pour se briser de la sorte. On parle alors de « fission induite ». Et ce coup de pouce, c’est l’absorption d’un neutron venu de l’extérieur qui va le donner.
Et c’est là qu’entre en scène l’uranium : l’élément 92 du tableau, possédant donc 92 protons dans son noyau (c’est du lourd). L’uranium existe à l’état naturel sous la forme de trois isotopes : l’uranium 238 (99,28% du total), l’uranium 235 (0,72% du total) et l’uranium 234 (à l’état de traces). Tous trois sont radioactifs (radioactivité alpha, avec des demi-vies très longues) mais un seul est fissile : l’uranium 235. Il s’agit même du seul élément fissile existant à l’état naturel, tous atomes confondus. Rappelons qu’il se nomme « uranium 235 » parce qu’il possède 143 neutrons en plus de ses 92 protons (la somme faisant 235). L’uranium 238, le plus abondant (et de loin) mais non fissile, détient donc trois neutrons de plus.
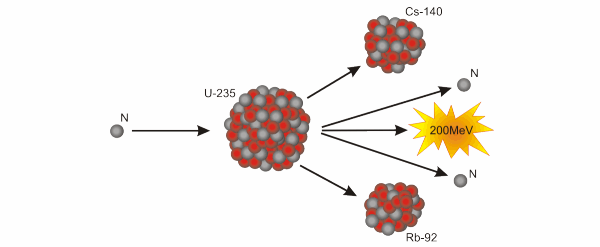
Vous pouvez voir ci-dessus un exemple de fission de l’uranium 235 (donnant du césium et du rubidium). Ce n’est qu’un exemple car il peut se casser en d’autres morceaux mais, à chaque fois, il libère aussi 2 ou 3 neutrons. Ce sont ces neutrons expulsés qui vont, à présent, nous intéresser. Comme vous pouvez l’imaginez, ces neutrons peuvent à leur tour être captés par d’autres atomes d’uranium 235 qui vont, eux-mêmes, se briser et éjecter d’autres neutrons, etc. C’est ce que l’on appelle une réaction en chaîne. Et, lorsque ce n’est pas maîtrisé, et parce que chacune de ces fissions libère une énorme quantité d’énergie, cela s’appelle aussi une explosion atomique (oui, Hiroshima).
Toutefois, tout n’est pas aussi simple. Pour que cet atome 235U capte le neutron, il faut que ce dernier ne soit ni trop lent, ni trop rapide. Il faut donc savoir maîtriser cela par différentes techniques. De plus, dans la nature, l’uranium 235 est rare au milieu de l’uranium 238. De fait, tous les neutrons éjectés lors d’une fission d’un 235U ont toutes les chances, soit de s’échapper, soit d’être captés par des atomes d’uranium 238, devenant ainsi des atomes d’uranium 239 qui, eux, vont juste se transformer (par radioactivité) en neptunium 239, puis en plutonium 239. De la radioactivité, certes, mais pas de fission, et encore moins de réactions en chaîne.
Pour que l’uranium puisse être utilisé à des fins militaires, il faudra donc enrichir cet uranium, c’est à dire augmenter fortement la proportion d’uranium 235 par rapport à l’isotope 238. Lorsque vous entendrez parler, dans l’actualité, des usines d’enrichissement d’uranium en Iran, vous saurez enfin de quoi il s’agit.
Bien sûr, la fission nucléaire a aussi des applications civiles. Il y a de grandes chances que l’ordinateur que vous utilisez en ce moment, soit alimenté par cette énergie via des centrales nucléaires qui transforment la chaleur issue de ces fissions en vapeur d’eau faisant tourner des turbines qui créent de l’électricité. Ces centrales utilisent également de l’uranium enrichi, sous forme de barres de combustible. Toutefois, cet uranium est moins enrichi que pour les militaires car on a besoin d’entretenir la fission mais sûrement pas d’une réaction en chaîne explosive. On utilise d’ailleurs aussi des barres de contrôle qui vont permettre en absorbant les neutrons, de piloter le rythme de la fission.
Un petit mot sur le plutonium. Bien qu’enrichi, l’uranium utilisé dans les centrales contient toujours énormément d’uranium 238, non fissile. Comme nous l’avons dit, cet 238U, soumis au bombardement des neutrons, va finir par se transformer en plutonium 239. Or ce 239Pu qui, en quelque sorte, est un déchet des centrales nucléaires, se trouve être, lui aussi, fissile. Il est même beaucoup plus facilement fissile que l’uranium 235, et libère encore plus de neutrons. Plutôt que d’en faire un déchet (très dangereux), on a créé des centrales nucléaires capables de l’utiliser comme combustible, mélangé avec de l’uranium. Et même avec de l’uranium appauvri (ce qui nous était resté sur les bras après la phase d’enrichissement de l’uranium). C’est ce que l’on appelle du mox. Il existe même des centrales nucléaires pouvant créer plus de combustibles qu’elles n’en consomment (par le biais de la transformation de l’238U en 239Pu). Ce sont des surgénérateurs, comme le défunt projet Superphénix en France (ça n’a pas l’air si évident de passer de la théorie à la pratique industrielle).
Ce plutonium a aussi des applications militaires. Il est même plus aisé d’en faire une bombe A qu’avec l’uranium (fission plus facile et plus grand nombre de neutrons relâchés). La deuxième bombe tombée sur le Japon (Nagasaki, photo ci-dessous) était d’ailleurs une bombe au plutonium. Le fait que les centrales civiles en produisent naturellement pose bien sûr des problèmes, sachant toutefois que la récupération de ce plutonium (ainsi que vous faites pour les cendres de votre cheminée) est plus ou moins difficile selon le type de centrales (cf. Iran).

Précision utile :
Cet article est une explication des phénomènes physiques en jeu, même s’il était difficile de ne pas évoquer certaines utilisations et certains risques. Merci de ne pas en faire une source de débats sur l’utilité ou le danger du nucléaire. Ce débat est utile, important mais ici, ce n’est pas le but.
Fusion nucléaire
Comme pour la radioactivité et la fission nucléaire, il s’agit aussi ici de faire passer des atomes d’une case à l’autre de notre tableau. Mais au lieu de casser des noyaux d’atomes lourds, nous allons ici faire fusionner des noyaux d’atomes légers. Par exemple, faire un noyau d’hélium en collant deux noyaux d’hydrogène. Sachez que si la première opération (fissionner du lourd) produit une énorme quantité d’énergie, la seconde (fusionner du léger) produit, quant à elle, une énergie… colossale !
Dès lors, on peut se demander pourquoi on continue à faire de la fission plutôt que de la fusion dans nos centrales nucléaires. La raison est simple : s’il est facile de casser des noyaux lourds (certains se brisant même tout seul), il est, en revanche, très très très difficile d’obliger deux noyaux à se rapprocher, et encore plus à fusionner.
En effet, la force (nommée « force nucléaire forte ») qui colle entre eux les protons et les neutrons dans le noyau est très puissante… mais elle n’agit qu’à très faible distance. A l’inverse, une autre force (électromagnétique), certes moins puissante mais de portée infinie, vient tout faire pour éloigner les deux noyaux, car tous deux sont de charge électrique positive (du fait de la présence des protons en leur sein).
C’est un peu comme si vous badigeonnez de colle forte à prise rapide les faces de même polarité de deux aimants. Sans doute avez-vous déjà essayé de plaquer l’un contre l’autre les mêmes faces de deux aimants. Vous sentez qu’il faut lutter. En insistant fortement, vous y parvenez. Et ce n’est qu’à ce moment-là que la colle peut agir.
Pour les atomes, c’est la même chose. Pour y parvenir, il faut les agiter très fortement (cela s’appelle de la chaleur) et espérer que leur vitesse leur permette de vaincre cette intense répulsion électromagnétique. Mais la chaleur dont on parle ici, s’élève à des dizaines de millions de degrés, voire des centaines de millions de degrés selon la nature des atomes ! Et encore, faut-il qu’il y ait aussi une énorme densité et que cela dure assez de temps pour espérer que des noyaux se tamponnent. Bref, ce n’est pas simple.
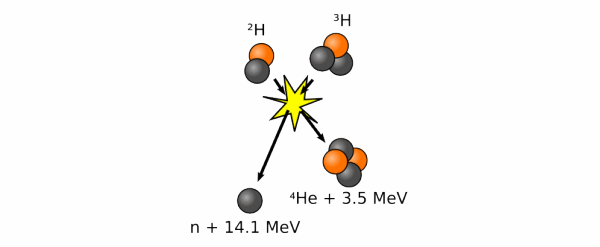
La fusion la plus simple – enfin, la moins complexe – à mettre en œuvre, concerne la fusion de l’hydrogène, donnant de l’hélium au final (schéma ci-dessus). Mais, pour que cela fonctionne au mieux, il faut utiliser non pas l’hydrogène le plus courant (1 proton) mais deux isotopes bien plus rares : le deutérium (de l’hydrogène avec 1 proton + 1 neutron) et le tritium (de l’hydrogène avec 1 proton + 2 neutrons). La fusion d’un deutérium et d’un tritium va donner de l’hélium 5 (2 protons et 3 neutrons). Cet hélium 5, instable, va de suite expulser un neutron pour trouver sa configuration la plus stable : l’hélium 4 (2 protons + 2 neutrons). Entre temps, une énergie colossale sera dégagée par l’opération, bien plus importante que l’énergie qu’il aura fallu utiliser pour la produire. Qui plus est, le résultat (hélium 4) n’est pas radio-actif (cela nous change de la fission de l’uranium ou du plutonium). Un petit bémol toutefois : les neutrons expulsés risquent de rencontrer des atomes dans leur environnement, et de les rendre, eux, radio-actifs.
Là, vous vous demandez si nous sommes parvenus à réaliser cette fusion. La réponse est oui, et cette grandiose réussite s’appelle la « bombe thermonucléaire » ou « bombe H » (H pour hydrogène). Et pour parvenir à obtenir la température et la pression rendant possible cette fusion de l’hydrogène, on a utilisé… une bombe A (celle de tout à l’heure). Oui, ici, c’est bien une bombe A qui sert de détonateur à une bombe H qui, elle, va faire encore bien plus de dégâts.
La première bombe H fut développée par les Américains, et testée en 1954 dans le Pacifique, sur l’atoll de Bikini (oui, comme le truc très « fusionnel » sur les plages, l’été). Suivirent une série d’autres « tests » mis en œuvre par différentes puissances dont les Soviétiques qui, en 1961, firent exploser dans l’océan arctique ce que l’on nomma la « Tsar Bomba » : 3125 fois plus puissante que la bombe d’Hiroshima, ce qui en fait l’arme la plus puissante jamais utilisée dans l’histoire de l’humanité.
La photo ci-dessous est celle de l’explosion de 54 à Bikini, dix fois moins puissante que « Tsar Bomba ».

Bon, à part jouer à « J’en ai une plus grosse que toi », les hommes ont-ils cherché une application plus pacifique de cette énergie ? Oui, et ils rêvent que cela puisse résoudre tous les problèmes d’énergie de l’humanité. Et, à force d’efforts, ils sont même parvenus à réaliser cette fusion sans avoir besoin de faire exploser un pétard atomique. Mais de manière très expérimentale : quelques atomes, très peu de temps et en dépensant beaucoup d’argent.
La méthode consiste à utiliser un gigantesque aimant (que l’on appelle un « tokamak ») en forme de pneu (ou de tore si vous voulez faire plus sérieux) pour confiner et amener des noyaux d’hydrogène (deutérium et tritium) aux conditions exigées pour la fusion. On y arrive un peu mais il reste une quantité phénoménale de problèmes à résoudre avant de pouvoir espérer en faire la source d’énergie de l’avenir.
C’est l’objet du plus grand projet scientifique international actuellement mené (projet « ITER »). C’est en France, à Cadarache, mais il s’agit bien d’un projet international (USA, Russie, Japon, Inde, Corée du sud, Suisse et l’Union européenne) car son coût est phénoménal. Mais l’enjeu est là : offrir à l’humanité, dans la seconde partie du XXIème siècle, une énergie presque gratuite, presque sans limite, presque propre, presque sans risque (il y a des débats sur les « presque », je n’y rentre pas).
Notons qu’une autre méthode, utilisant le laser, fait également l’objet de recherche (mais n’est pas plus avancée), avec notamment le projet « HIPER ».

Ah, j’ai oublié de vous le dire : cette fusion nucléaire, sous des formes diverses, constitue le moteur de toutes les étoiles, dont le Soleil. Eh oui, c’est bien grâce à la fusion nucléaire que vous pouvez bronzer dans votre jardin. C’est aussi grâce à elle qu’il y a du vent, de la pluie et de la vie.
Mais ce n’est pas tout ce que j’ai omis de vous dire…
Ce que je ne vous ai pas dit
Nous parvenons au terme de ce magnifique exposé sur la matière, et je dois bien avouer que je vous ai caché certaines choses. Des choses qui feront – si tout va bien – l’objet d’autres articles.
Cendres d’étoile
Je n’ai pas évoqué l’histoire de la matière, du Big Bang à nos jours. Je le ferai prochainement. Sachez quand même que beaucoup des atomes qui vous constituent, sont en fait… des cendres d’étoiles !
Antimatière
Oui, ce n’est pas qu’un sujet de science-fiction, l’antimatière existe. Pour chaque type de particule, il existe en effet un type d’anti-particule possédant des charges opposées (exemple : le positon qui est un anti-électron). Mais lorsque de l’antimatière rencontre de la matière, tout est annihilé dans un grand éclat de lumière (gamma). Ceci explique que l’antimatière, créée notamment lors de processus radioactifs (votre corps produit plusieurs milliers de positons par seconde), demeure très rare et a une durée de vie très limitée. Dans l’univers – et vous êtes là pour le prouver – c’est bien la matière qui a remporté la mise. Pourquoi ? C’est l’une des grandes questions de la physique moderne. Nous en reparlerons un jour.
Quarks
Je vous ai parlé de « grosses particules » appelées protons et de neutrons. Sachez que ces particules sont en fait, chacune, composées de trois particules plus élémentaires : des quarks (2 « up » et 1 « down » pour le proton, et 2 « down » et un « up » pour le neutron). En vérité, il existe bien plus de particules élémentaires que cela dans le bestiaire de l’univers. Nous poursuivrons plus avant notre exploration de la matière lorsque nous étudierons le « modèle standard de la physique des particules ».
Matière noire
En étudiant l’univers, et notamment le mouvement des galaxies, les astrophysiciens ont pu déterminer la masse de matière contenue par ces galaxies et amas de galaxies. Le problème est que lorsqu’ils comptabilisent toute la matière que ces galaxies contiennent, ils n’obtiennent qu’un cinquième du nombre attendu. Pour dire les choses autrement : la matière ordinaire, celle qui compose les étoiles et vous-même, ne compte que pour 1/5e de la matière de l’univers, les 4/5e qui manquent (ce qui n’est pas rien !) représentent ce que l’on nomme la « matière noire » (ou « sombre »). Les qualificatifs « noire » ou « sombre » représente surtout notre grande ignorance à ce sujet. D’ailleurs existe t-elle ? Est-ce un problème plus théorique ? Ceci est un domaine de recherche passionnant, susceptible de remettre en cause ou de faire avancer nos connaissances sur l’univers et ses lois. Cela vous intéresse ? Un jour, promis.
Quantique
Pour finir en beauté, sachez que tous les croquis que je vous ai proposé, montrant des petits grains de matière (électrons) tournant autour d’autres grains de matière agglomérés dans un noyau (protons et neutrons)… ne correspondent pas à la réalité. Oubliez l’idée d’un système solaire en miniature pour décrire l’atome car les particules dont il est question sont des objets décrits par la physique quantique. Ce ne sont ni des particules (ou alors vous devrez m’expliquer comment faire passer une bille par deux trous en même temps), ni des ondes. Ce sont d’autres choses. Et lorsque nous commencerons à les étudier, il vous faudra préparer vos bagages pour un bien étrange voyage.
Le joli tableau de Mendeleïev
- Partie 1 : Esquisse et présentation du tableau
- Partie 2 : Derrière le tableau
- Partie 3 : La chimie dans le tableau
- Partie 4 : Le nucléaire dans le tableau
Si cela vous intéresse, notre descente au cœur de la matière se poursuit dans un autre article intitulé « Un étonnant modèle standard ».