Dans le tableau de Mendeleïev, nous avons tout d’abord trouvé des éléments chimiques, avant d’y découvrir des atomes et leurs composants. A présent, étudions de plus près, l’un de ses composants : l’électron. Car ce sont bien ces petites charges négatives tournant autour du noyau qui vont donner ses propriétés chimiques à l’atome. Et tout cela vient d’une règle très simple (du moins en apparence)…
La chimie dans le tableau
Donc, pour simplifier les choses, disons que les électrons peuvent se déplacer au sein de différentes couches électroniques. La première – la plus proche, nommée « K » – ne peut contenir que deux électrons. La seconde, « L », peut en contenir huit, la troisième, « M », dix-huit, la quatrième, « N » trente-deux, la cinquième, « O », cinquante… Il y a encore les « P » et « Q », et peut-être d’autres encore mais on va s’arrêter là.
Les électrons d’un atome vont remplir les différentes couches en commençant par la plus proche jusqu’à la plus éloignée du noyau. Toutefois, à partir de la 3ème couche, dès qu’ils en auront huit, ils vont commencer à remplir la quatrième puis en chemin, vont finir de remplir la 3ème. Arrivés au 8ème électron de la 4ème couche, ils vont également se mettre à remplir la 5ème, etc.
Je ne vais pas rentrer dans les explications (quantiques) mais disons que les atomes adorent avoir huit électrons sur leur couche externe (et deux pour la première qui ne peut en contenir plus).
Je vous propose une autre version du tableau périodique des éléments. Outre le fait qu’il affiche en plus les éléments chimiques artificiels (au-delà des 94 premiers), il montre dans chaque case (en haut à droite de chaque case) le remplissage des différentes couches électronique (cliquez pour mieux voir, puis refermez l’onglet pour revenir ici).
Vous pouvez également remarquer que les éléments situés dans une même colonne ont généralement le même nombre d’électrons sur leur couche externe. C’est un peu plus compliqué au milieu. Et, pour la dernière colonne, n’oubliez pas que l’hélium (He) ne peut avoir que 2 électrons sur sa première et seule couche.
Vous vous souvenez que Mendeleïev avait choisi de mettre dans une même colonne, les éléments ayant les mêmes propriétés chimiques. Vous l’avez compris, c’est le nombre d’électrons présents sur cette couche externe qui va déterminer les propriétés chimiques en question. Et cela, en raison d’un principe simple (nommé « règle de l’octet ») que nous avons déjà évoqué : les atomes adorent avoir huit électrons sur cette dernière couche (ou deux si cette dernière est aussi la première). Et ils vont tout faire pour y parvenir.
De ce « tout faire » est née la chimie !…
Mais de quelles astuces les atomes vont-ils se servir pour parvenir à ces huit électrons en façade ?
Première méthode : partager les électrons
Les atomes peuvent en effet mettre en commun les électrons de leur couche externe respective. La liaison que les atomes forment ainsi est appelée « liaison covalente », et c’est assez costaud. Ces paquets d’atomes ainsi reliés s’appellent… des molécules.
Prenons quelques exemples…
L’hydrogène n’a qu’un électron sur sa première et seule couche électronique. Il lui en manque un pour compléter cette couche. Vous pouvez imager cela en disant que l’hydrogène possède un bras tendu, prêt à capter un électron.
L’oxygène possède huit électrons (2 sur la première couche, et 6 sur la seconde). Il lui manque donc 2 électrons pour compléter sa seconde couche. Il a donc 2 bras.
Cela explique pourquoi l’hydrogène et l’oxygène ne se promène pas dans la nature sous forme d’atomes libres mais sous forme de molécules H2 et O2. En effet, lorsque deux atomes d’hydrogène se rencontrent, ils se tiennent aussitôt par leur unique bras. Idem pour les deux atomes d’oxygène, si ce n’est que, eux, se tiennent chacun par leur paire de bras. Plus rarement, les atomes d’oxygène peuvent se mettre à trois, comme trois gamins faisant la ronde en se tenant par la main. Ils forment ainsi une molécule O3 (c’est ce que l’on appelle de l’ozone).
Bien sûr, les atomes peuvent aussi se lier à d’autres types d’atomes. Si, dans une bonbonne, vous mélangez de l’hydrogène et de l’oxygène… il ne se passe rien (les molécules sont très bien comme elles sont). Mais en les forçant à se taper dessus violemment (traduction : en les chauffant), cela peut donner autre chose. Ici, une simple étincelle suffit pour exciter quelques molécules. Et dans ce choc, des atomes d’oxygène vont se détacher de leur compère, et leurs deux bras libres vont venir se lier au bras de deux atomes d’hydrogène, eux aussi détachés, formant ainsi une molécule H2O (oui, c’est de l’eau, et c’est ce qui est représentée ci-dessous).
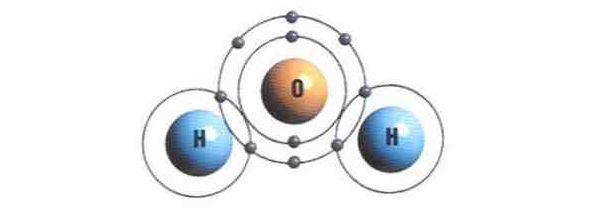
Pour se lier entre eux, deux atomes d’oxygène avaient dû, en quelque sorte, plier leurs deux bras, ce qui leur avait coûté de l’énergie. En revanche, en se liant à deux petits hydrogène, l’atome d’oxygène peut détendre ces deux bras. De ce fait, il rend de l’énergie (sous forme de mouvement, ce que l’on appelle de la chaleur), et vient taper d’autres molécules d’hydrogène et d’oxygène qui se transforment, à leur tour, en eau, et le processus se poursuit… C’est ce que l’on appelle une réaction en chaîne, ou plus prosaïquement, une explosion !
Ce qui vient d’être décrit, est une « réaction chimique » mais, je vous rassure, toutes les réactions chimiques ne donnent pas lieu à une explosion. Par exemple, la réaction inverse (faire de l’oxygène et de l’hydrogène avec de l’eau) nécessite au contraire d’apporter continuellement beaucoup d’énergie, sans en recevoir en retour.
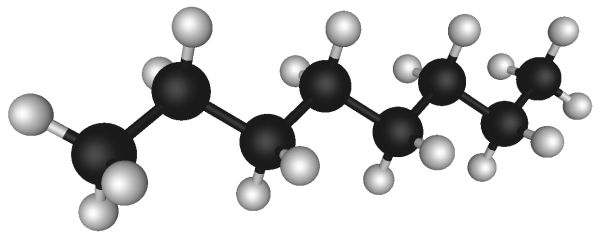
Un petit mot sur le carbone pour clore ce sujet. Il manque à celui-ci quatre électrons pour remplir sa dernière couche. Il a donc quatre bras. Qui plus est, il est relativement abondant par rapport à la plupart des autres éléments. Si vous deviez construire des molécules à partir de la boîte de Lego de l’univers, vous pourriez vraiment vous amuser avec ces atomes de carbone et leurs quatre bras. Vous pouvez bien sûr leur coller deux atomes d’oxygène (CO2, du dioxyde de carbone, aussi appelé gaz carbonique), ou quatre hydrogène (CH4, du méthane), ou mieux : former de gigantesques chaînes de carbone avec de l’hydrogène sur les côtés (des hydrocarbures ou du plastique) ou encore y adjoindre en plus des atomes d’azote et d’oxygène pour construire nombre de molécules qui nous composent. Si vous vous amusez avec ces Lego à quatre branches que sont les atomes de carbone, cela s’appelle faire de la chimie organique. Oui, les chimistes sont de grands enfants… qu’il faut donc surveiller.
Ci-dessous une molécule d’octane avec ses huit « carbone » et ses seize « hydrogène ».
Deuxième méthode : éjecter ou capturer des électrons
Pour parvenir à respecter la règle de l’octet, certains atomes ne vont guère s’embêter. S’ils ont un petit peu d’électrons en trop, ils vont s’en débarrasser. S’il leur en manque un tout petit peu, ils vont en voler. En faisant cela, ces atomes se transforment en ions (positifs s’ils perdent un ou plusieurs électrons, négatifs s’ils en gagnent car, rappelons-le, l’électron, c’est une charge négative)
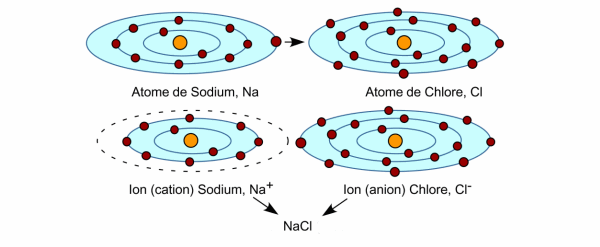
Prenons le cas du sodium. Il possède 11 électrons : 2 dans la première couche, 8 dans la deuxième, et un unique électron sur la troisième couche. Grande est donc son envie de s’en débarrasser pour présenter une couche externe pleine (la deuxième).
Voyons à présent le cas du chlore et de ses 17 électrons : 2 dans la première couche, 8 dans la deuxième, et 7 dans la troisième. Rageant : il lui en manque juste un pour la troisième. Si l’on se souvient de la première méthode, il dispose donc d’un bras comme l’hydrogène. Et de fait, on retrouve le chlore dans de nombreuses molécules comme le gaz de chlore (Cl2) ou le polychlorure de vinyle : une longue chaîne de carbone avec, sur les côtés des atomes d’hydrogène et, une fois sur trois, un atome de chlore (c’est le PVC). Ceci étant dit, le chlore n’est pas contre une autre solution, à savoir carrément voler un électron à un autre atome.
Que se passe t-il quand nos deux compères se rencontrent ? Vous l’avez compris : les atomes de chlore viennent chiper l’électron en trop des atomes de sodium. On obtient donc des ions sodium (Na+) et des ions chlore (Cl–). Et un peu comme deux aimants de polarité opposés, ils ne trouvent rien de mieux que de se coller l’un à l’autre. Cette liaison s’appelle une liaison ionique. C’est un peu moins costaud que la liaison covalente (première méthode) mais c’est quand même solide.
Ah, j’oubliais, le corps que l’on vient ainsi de former, s’appelle du chlorure de sodium (NaCl). Ne faites pas les dégoûtés, vous en mettez sur vos frites (c’est du sel de table). Bien sûr, il existe une foultitude d’autres composés ioniques, bâtis sur le même principe mais dont il vaut mieux éviter de saupoudrer vos frites.
Troisième méthode : former un cristal
Les atomes qui ont peu d’électrons sur leur couche externe, tel le sodium que nous venons de voir, ont de la difficulté à s’assembler avec leurs semblables. Ils ne peuvent pas utiliser la deuxième méthode car ils deviennent tous des ions positifs, et n’ont donc qu’une envie : se séparer les uns des autres pour s’assembler avec des ions négatifs. Quant à la première méthode, ces atomes ont jusqu’à sept bras, et peinent donc à les plier tous afin de rejoindre un autre copain à sept bras.
Ils vont donc adopter une troisième méthode : former un cristal, c’est à dire s’assembler en très grand nombre, les uns avec les autres, selon une parfaite régularité, tout en mettant en commun leurs électrons en trop. C’est un peu un mixte des deux précédentes méthodes : ils se débarrassent de leurs éléctrons mais les mettent également en commun afin que l’ensemble reste électriquement neutre. Je ne vais pas rentrer dans les détails mais on dit qu’ils forment un cristal métallique. Oui, car j’ai oublié de vous préciser que les éléments avec plein de bras dont je vous parle sont ce que l’on appelle des métaux (que ce soient des métaux alcalins, comme le sodium, des métaux alcalino-terreux, comme le magnésium, ou tout simplement des métaux, comme le fer ou l’or).
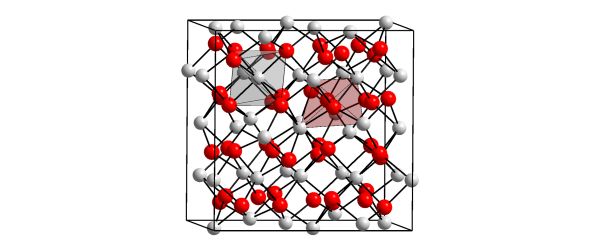
C’est un peu hors sujet, mais notez que les métaux ne sont pas les seuls à former des cristaux, c’est à dire des rangement solides et ordonnés. Cela peut être des molécules (glace d’eau par exemple) ou des composés ioniques (comme le sel de table que nous avons vu). Dans ce cas, ils ont tendance à former de grands ensembles cristallins du fait qu’ils possèdent eux-mêmes une bi-polarité électrique (un côté « + » et un côté « – »). Enfin, d’autres atomes, comme le carbone, peuvent également former des cristaux mais là, ils utilisent bien la première méthode (liaisons covalentes) : imaginez tous ces atomes de carbone avec leurs quatre bras que vous assembleriez dans tous les sens à l’infini (ou presque). En plus, leurs bras étant un peu élastiques, vous pouvez les assembler selon différents arrangements pour faire soit du graphite (pour vos mines de crayon), soit du diamant (pour payer votre yacht).
Quatrième méthode : laissez-moi tranquille
Comme vous pouvez le voir dans le tableau, les éléments situés dans la dernière colonne (en bleu clair) ont naturellement sur leur couche externe le nombre d’électrons adéquat. Dès lors, quelle sera leur activité chimique ?… Nulle, rien, nada… Ces atomes – que l’on appelle des « gaz rares » et dont le plus connu et le plus abondant est l’hélium – sont très bien comme ils sont, et ne cherchent donc pas à s’acoquiner avec d’autres, que ce soient leurs congénères ou d’autres atomes. Il n’y a rien à attendre d’eux sur le plan chimique. Ils n’ont pas de bras.
C’est pourquoi vous pouvez voler dans un ballon gonflé à l’hélium sans craindre qu’il s’enflamme : les atomes d’hélium vivent en solitaire, et n’iront pas conter fleurette aux atomes d’oxygène présents dans l’air.
Le dirigeable Hindenburg que l’on voit ici terminer en flammes lors de son atterrissage en 1937, était, lui, gonflé à l’hydrogène, notamment pour des raisons de coût. Un choix qui fit 35 morts… et un peu d’eau.

Voilà… Je dois toutefois préciser que, pour ne pas m’étendre, j’ai laissé de côté d’autres types de liaisons chimiques, et que tout n’est pas aussi simple, notamment pour la règle de l’octet avec les atomes très lourds. Mais bon, vous savez l’essentiel.
Ce que vous venez de découvrir est ce qui fonde toute la chimie. Mais que ce soit clair : cela ne concerne pas que les laboratoires. La chimie est partout, aussi bien dans votre cuisine que dans votre corps. Partout dans l’univers.
Dans cette avant-dernière partie, nous avons beaucoup parlé d’électrons, mais il reste encore des choses à piocher dans notre table de Mendeleïev. Et cette fois-ci, cela se passe dans le noyau des atomes…
Le joli tableau de Mendeleïev
- Partie 1 : Esquisse et présentation du tableau
- Partie 2 : Derrière le tableau
- Partie 3 : La chimie dans le tableau
- Partie 4 : Le nucléaire dans le tableau






Merci pour cet abord simplifié, certes mais qui est une approche attirante sans bourrage de crane. Mais qui les laissent apercevoir.
Cdt,
Michel.
Mon nom est dans l’adresse mail.
Merci Michel,
Bonne lecture si vous poursuivez sur mon site.